近日,药物所王朝辉课题组和合作团队在国际权威期刊Advanced Materials发表了题为“Tumor microenvironment-responsive nanoparticles amplifying STING signaling pathway for cancer immunotherapy”的研究论文。该工作在课题组前期研究基础上,探索了协同增强免疫激活作用的新策略,提高了肿瘤免疫治疗效果。
免疫治疗为癌症治疗和治愈带来了新希望,但是免疫系统激活效力不够和抑制性微环境导致了疗效不佳(特别是实体瘤)和低应答率。作为人体免疫系统的第一道防线,固有免疫在启动免疫应答方面发挥了重要作用。其中,激活环GMP-AMP合成酶(cGAS)-干扰素基因刺激因子(STING)通路可产生Ⅰ型干扰素,诱导先天性和获得性免疫反应,在抗肿瘤免疫治疗中发挥着重要作用。然而,肿瘤组织特殊的微环境抑制或破坏STING通路的激活,制约了其治疗作用的发挥。
基于此,研究团队开发了肿瘤微环境响应型纳米颗粒共递送STING和TLR4激动剂,以实现对先天性免疫刺激的时空调控,协同发挥抗肿瘤免疫治疗效果。该纳米颗粒到达肿瘤微环境解离成聚合物单链,迅速释放激动剂MPLA和Mn3O4 NPs,Mn3O4 NPs酸解为Mn2+,二者有效激活TLR4和STING天然免疫通路。其中TLR4介导的NF-κB能够促进微管解聚,进而抑制STING蛋白运输到溶酶体进行降解,有效增强Mn2+介导的STING信号通路激活,协同诱导I型干扰素和其他炎症细胞因子的分泌。该纳米药物可高效激活T细胞、NK细胞杀伤肿瘤细胞,同时降低调节性T细胞、M2型巨噬细胞的比例,缓解免疫抑制微环境,发挥免疫增强作用。与免疫检查点拮抗剂(aPD-1)联用能够更进一步提高免疫细胞的作用,显著抑制了小鼠肿瘤的生长。
本研究构建的新型pH超敏感聚合物通过一步自组装工艺递送激动剂,制备简单,实现了TLR4和STING激动剂的协同效应,提高免疫激活作用的强度和持久性,对新型肿瘤治疗策略的开发提供了重要的参考和思路,并且与现有的免疫检查点疗法联合能够更进一步提高治疗效果,拓展了临床转化前景。该工作得到了国家自然科学基金(52202356)、医科院基本科研业务费(2021-RC350-001)等项目的资助。博士研究生刘丹为该论文的第一作者,药物所王朝辉研究员、新加坡国立大学陈小元教授和深圳湾实验室饶浪研究员为共同通讯作者。
论文链接:https://onlinelibrary.wiley.com/doi/abs/10.1002/adma.202304845
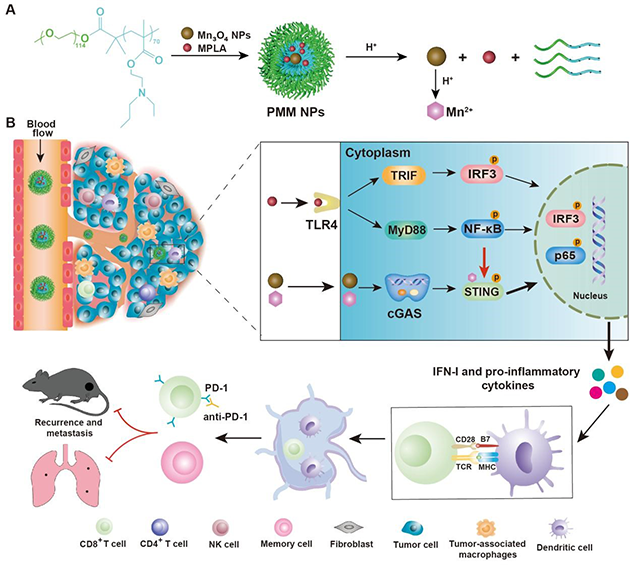
图. 肿瘤微环境响应型纳米递送系统的构建及调控天然免疫通路的机制示意图

