小核酸是新兴的生物治疗候选药物,通过靶向目的基因的表达产生治疗作用。但是由于小核酸药物释放的技术难题一直未能解决,其发展受到严重阻碍。2014年来中国医学科学院药物研究所“天然药物活性物质与功能国家重点实验室”药理学蒋建东研究员、合成药物化学吴松研究员、药物制剂学郑稳生研究员牵头的三个课题组通力协作,通过学科交叉对此瓶颈问题展开研究,在小核酸药物的靶向递送技术上获得进展,于2017年6月在《Biomaterials》等杂志上发表。
1998年Fire A等首先发现了RNA干扰(RNAi)现象并因此获得2006年诺贝尔奖,开启了人类对RNA调控的研究,RNA干扰已经被研究用于基因治疗的新药研发。新的研究进一步表明,小分子RNA也能够激活目的基因的表达,体现了其在基因组功能调控中的多样性。 2006年北京协和医院李龙承教授领导的课题组(当时在美国UCSF)利用21nt的小双链RNA,以目的基因的启动子为靶标成功引起序列特异性的基因转录激活,他将这一现象命名为RNA介导的基因转录激活,简称RNA激活(RNA activation,RNAa),并把这样的dsRNA称为小激活RNAs(small activating RNA,saRNAs; PNAS,2006)。因其引起基因表观遗传的变化,与小干扰RNA (siRNA) 相比,作用更强而持久。Science评价认为RNAa作为一种新的小核酸物质可能发展成为新的治疗药物。在共同讨论后,李龙承教授与药物所专家认为有必要对此基础发现开展运用研究。
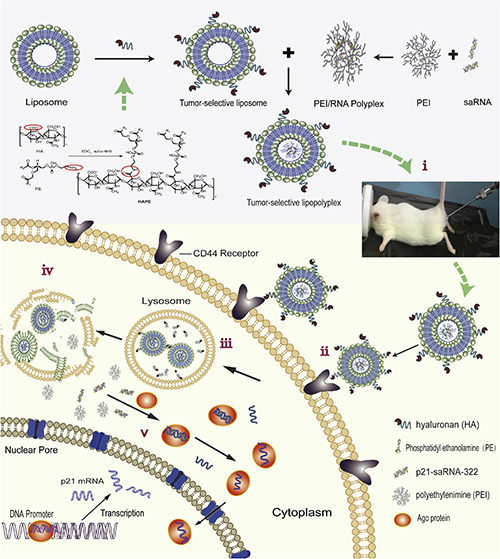
然而,有效的递送系统一直是阻碍小核酸类治疗药物走向临床的瓶颈问题。在证实了具有特殊序列的小双链RNA(p21-saRNA-322)对肠癌的治疗作用后,上述三个课题组对p21-saRNA-322进行药物递送系统的构建研究。他们利用肠癌的生理、病理特点,创建了一种具有特殊壳核结构的小核酸递释系统-生物粘附脂质多聚复合物,研制的递释系统由具有生物粘附性及肿瘤靶向性的外壳,结合对肿瘤内环境敏感的内核组成。
据第一作者王璐璐副研究员介绍:“在该项研究中,我们首先设计将含有伯氨基的小分子量PEI与二硫基丙酸通过形成酰胺键结合,构建基于二硫键交联的嵌合型PEI衍生物载体(PEI-SS),该嵌合载体能够有效固缩小核酸形成对肿瘤内环境敏感的PEI-SS/saRNA复合物内核,被细胞摄取后可在肿瘤细胞内高还原状态下迅速分解,促进药物的释放提高药效,分解产物小分子量PEI可以在体内生物降解,从而提高载体的生物安全性;进一步设计将透明质酸通过酰胺缩合反应与磷脂材料二油酰基磷脂酰乙醇胺(DOPE)结合,以可控的修饰密度构建具有肿瘤靶向性及生物粘附性的脂质体外壳,包裹PEI -SS/saRNA内核,以达到病灶部位滞留和肿瘤靶向的目的” 。蒋建东研究员认为小核酸递送是一个全球性的科学难题,路还很长;此项研究体现了药物所研究人员知难而上的科研意识,从基础向应用延伸的探索精神,及不同专业间协同创新的文化传承。

