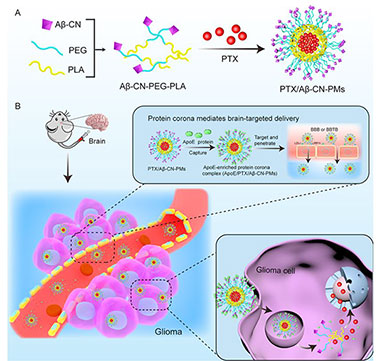
多肽介导脑靶向药物递送及释药系统与体内生物环境相互作用的研究近年备受瞩目。具有纳米尺度的药物递送系统在体内环境中与生物体相互作用,导致蛋白质等大分子物质以非特异性的方式吸附在纳米颗粒表面形成蛋白冠。基于上述现象,可将蛋白冠这一不利现象转化为实现脑靶向药物递送的新策略。目前,构建基于多肽和蛋白冠介导的脑靶向药物递送系统已成为研究热点。
近期,国际知名期刊《Journal of Nanobiotechnology》刊登了中国医学科学院药物研究所药物制剂室高钟镐课题组和黄伟课题组题目为“Novel brain-targeted nanomicelles for anti-glioma therapy mediated by the ApoE-enriched protein corona in vivo”的研究论文,该论文设计了一种由基于多肽和体内原位载脂蛋白冠介导的新型脑靶向纳米胶束用于脑胶质瘤的治疗。
研究人员构建了?淀粉样多肽衍生肽(A?25-35, A?-CN)修饰的装载紫杉醇的PEG-PLA胶束,胶束外壳上的A?-CN肽可与载脂蛋白的脂质结合域结合形成载脂蛋白丰富的蛋白冠,同时载脂蛋白冠的受体结合域可靶向于血脑屏障和脑胶质瘤细胞上高表达的低密度脂蛋白受体,从而完成纳米胶束的脑靶向递送。体内外实验表明载脂蛋白冠的形成可显著提高胶束穿过血脑屏障的能力,并对脑胶质瘤具有特异靶向性。这种方式既可以解决非特异性蛋白质吸附带来的脱靶和纳米粒被快速清除的问题,又可以借助形成的蛋白冠的靶向功能穿过血脑屏障,深入脑胶质瘤内部。
该工作得到了中国医学科学院医学与健康科技创新工程重大协同创新项目(2021-I2M-1-026)和中央高校基本科研业务费项目(3332021044)的资助。硕士研究生张喆傲为该论文的第一作者,黄伟研究员和高钟镐研究员为共同通讯作者。