近日,中国医学科学院药物研究所戴均贵、陈大伟团队与中科院微生物研究所刘宏伟团队在《Journal of the American Chemical Society》(美国化学会志)发表了题为“Targeted Discovery of Glycosylated Natural Products by Tailoring Enzyme-Guided Genome Mining and MS-Based Metabolome Analysis”的研究论文。该研究利用糖基转移酶导向的基因组挖掘策略,从真菌中高效定向发现多个结构新颖、药理活性广泛的糖苷化合物,为真菌中结构新颖活性天然产物的定向发现提供了新思路与新策略。
糖苷化合物是活性天然产物及临床药物的重要组成部分,其分子中的糖基基团不仅是重要的药效基团,还可改善化合物的药代动力学特性,增加成药性。天然糖苷化合物大多数来源于植物和细菌,真菌中发现的糖苷极少。目前,依靠传统发酵、提取分离方法从真菌中仅发现400多个糖苷化合物。自然界中至少存在200万种真菌,蕴含着巨大的糖苷类化合物生物合成潜力,但仅依靠传统的分离纯化手段严重限制了新颖活性糖苷化合物的高效发现与分子创新。因此,如何从数量庞大的真菌中高效、定向挖掘新颖结构活性糖苷并进行分子创新是目前该领域研究的难点。
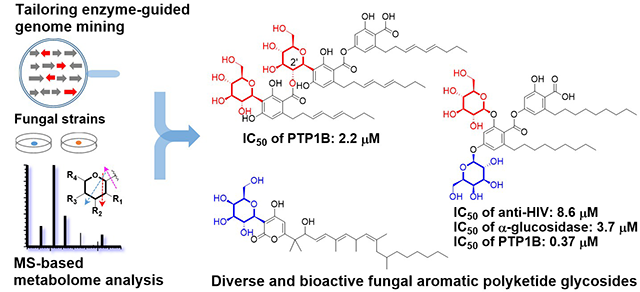
在该工作中,研究人员首先解析了聚酮C-糖苷stromemycin的生物合成途径,发现真菌中首个C-糖基转移酶AuCGT。以AuCGT为探针,通过同源蛋白挖掘、生物信息学分析,从NCBI等数据库中挖掘到158个AuCGT同源蛋白及80个候选菌株,通过antiSMASH分析预测,大部分AuCGT同源蛋白与聚酮合酶pks成簇分布,提示其合成聚酮糖苷化合物的潜力。
通过异源表达、更换培养条件、交换启动子等策略激活候选基因簇,并对7株真菌代谢产物进行分析,结合糖苷化合物的MS特征裂解规律,确定了它们合成糖苷化合物的能力。进一步基于LC-UV-MS指导定向分离,从3株真菌中分离得到28个糖苷化合物,其中20个为新化合物,包括缩酚酸C-糖苷、缩酚酸O-糖苷和α-吡喃酮C-糖苷等,糖基单元包括葡萄糖,半乳糖和脱氧糖,极大拓展了天然糖苷化合物的结构多样性。同时,将这些新颖糖基转移酶作为基因元件用于组合生物合成与分子创新,进一步拓展了糖苷化合物的结构多样性。
该研究为真菌中更多结构新颖糖苷甚至其它类型化合物的定向发现与分子创新提供了新思路与新策略,尤其是含量低微或生物合成基因簇沉默的天然产物。同时为抗病毒、抗菌、抗糖尿病等创新药物研发提供了结构类型多样的活性分子。
中国医学科学院药物研究所陈大伟副研究员、宋治军博士和中科院微生物研究所韩俊杰副研究员为共同第一作者,中国医学科学院药物研究所陈大伟副研究员、中科院微生物研究所刘宏伟研究员和中国医学科学院药物研究所戴均贵研究员为共同通讯作者。该研究得到了国家自然科学基金(Grant Nos. 82073716, 22177131)和医科院创新工程(2021-I2M-1-029)的支持。
原文链接:https://pubs.acs.org/doi/10.1021/jacs.3c12895