2024年3月26日,中国医学科学院药物研究所李广研究员团队在国际权威期刊Nature Communications (《自然通讯》)在线发表题为“Enantioselective Total Synthesis of (-)-Lucidumone Enabled by Tandem Prins Cyclization/Cycloetherification Sequence”(通过串联Prins环化/环醚化反应实现(-)-lucidumone地对映选择性全合成)的研究论文,该成果为具生物活性灵芝杂萜天然产物lucidumone的不对称全合成提供了新的方法。
Lucidumone是由深圳大学程永现教授课题组于2019年从中国云南省永胜县栽培的灵芝(Ganoderma lucidum)子实体中分离鉴定出了一种新型的杂萜类天然产物,该天然产物化学结构新颖复杂,具有复杂刚性笼状6/5/6/6/5五环结构,拥有六个连续的立体中心,使其全合成极具挑战。在生物活性方面,(-)-lucidumone显示了显著的COX-2抑制活性,研究表明(-)-lucidumone 通过结合Tyr385和Ser530残基选择性抑制COX-2,因其可以作为先导化合物进行抗炎药物的研发。
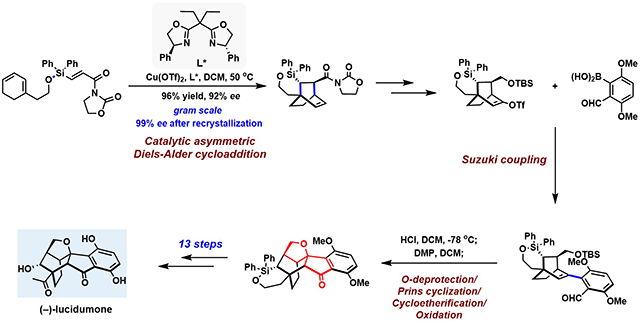
图. (-)-lucidumone的全合成路线
李广研究团队在对天然产物(-)-lucidumone化学结构深入剖析的基础上,利用铜催化的分子内不对称Diels-Alder反应以96%的收率,92% ee实现[2,2,2]双环辛烷结构的构建,成功实现了4个绝对手性中心(包括一个季碳中心)的引入,完成了第一个关键反应。该中间体经过简单的化学修饰与苯基硼酸进行Suzuki偶联,再进行关键的Brønsted酸催化的脱保护基/Prins环化/环醚化串联反应/氧化生成该天然产物的全碳核心骨架,经过后续的官能团转化和氧化态调整,高效简洁地以13步化学反应完成了(-)-lucidumone的不对称全合成。该研究工作不仅为该类复杂天然产物的合成提供了良好的方法和借鉴,也为后续药物化学和化学生物学相关研究奠定了坚实的基础。
该研究得到国家自然科学基金(No. 22371301),中国医学科学院基本科研业务费(2021-RC350-005)及中国医学科学院药物研究所天然药物及核药基础与新药创制全国重点实验室启动经费的支持。李广课题组2023级博士研究生廖献章和2021级硕士研究生王冉为该论文共同第一作者,李广研究员为通讯作者,助理研究员王欣博士在课题进行及论文撰写过程中做出了重要贡献。特别感谢瑞士洛桑联邦理工学院祝介平教授(Prof. Jieping Zhu)和清华大学药学院祖连锁教授为该工作提供的大力支持和帮助。
原文链接:https://doi.org/10.1038/s41467-024-46896-3