近日,中国医学科学院药物研究所李平平团队在Acta Pharmaceutica Sinica B(药学学报B)在线发表了题为“Intestinal epithelial cell NCoR deficiency ameliorates obesity and metabolic syndrome”(肠道上皮细胞核受体抑制子NCoR缺失缓解了肥胖和代谢综合征)的研究论文,发现了肠道NCoR1这一机体能量代谢的重要调节子及其作为代谢综合征治疗新靶点的潜力。
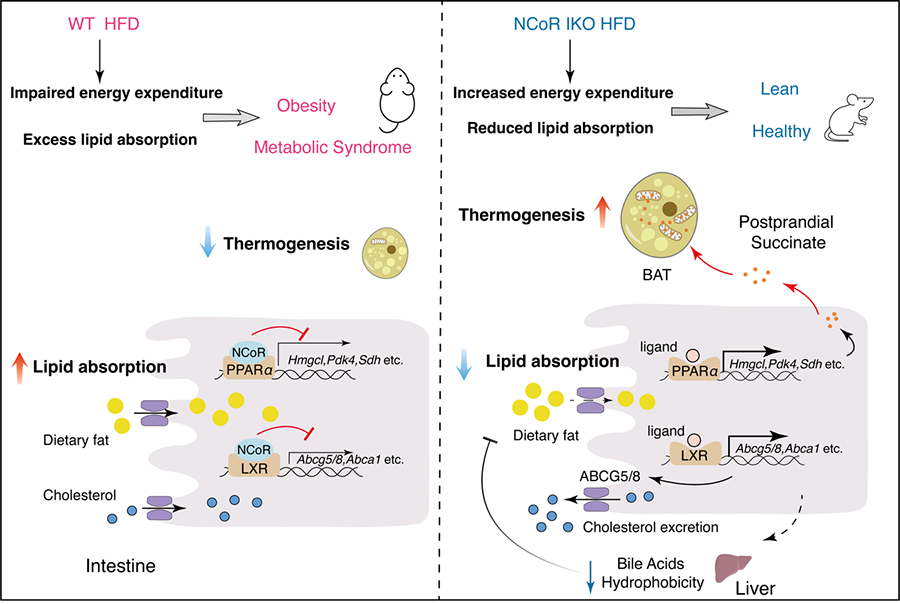
代谢综合征是包括肥胖、高血糖、血脂异常等病变在内的综合代谢性疾病,其发病的主要原因为能量代谢失衡。临床上主要应用的胰高血糖素样肽(GLP-1)类药物即通过抑制食欲,减少能量摄入来改善肥胖。脂质代谢主要由核受体如过氧化物酶体增殖物激活受体PPARα及肝脏X受体LXR等一类转录因子调节。在共辅助因子如NCoR1等的共同作用下,核受体结合并控制其靶基因转录,通过下游信号通路调节胆固醇、脂肪酸等多种脂质的吸收、合成和分解代谢,维持体内能量代谢稳态。作为核受体共抑制子的基本组成成分,NCoR1作用被广泛研究,其在脂肪组织、巨噬细胞、肌肉和肝脏等多个组织的敲除可通过激活某些特定的核受体来改善胰岛素抵抗,炎症及脂质代谢等。然而,在人体的另一重要代谢器官肠道,NCoR对机体代谢稳态的作用尚未阐明。
对此,本研究发现肠道上皮细胞中NCoR1的缺失可同时激活核受体PPARα和LXR,增加能量消耗,抑制脂质吸收,显著改善代谢综合征的肥胖,胰岛素抵抗,高血糖和高血脂等多项代谢异常。相比于GLP-1类药物具有的降低肌肉等非脂肪重量的副作用,肠道NCoR敲除对肥胖的改善主要来自于脂肪重量的降低,并不会影响非脂肪重量。机制研究发现,肠道NCoR1敲除激活了PPARα,进而通过脂肪酸氧化、酮体代谢等途径促进了肠道三羧酸循环代谢物琥珀酸的产生,琥珀酸被棕色脂肪组织摄取后显著增加了产热和能量消耗。同时,肠道PPARα激活促进脂质吸收的潜在副作用被同时激活的LXR所拮抗。肠道LXR的激活促进了胆固醇的外排,进而改变了胆汁酸的组成,从而抑制了脂质吸收。综上,肠道NCoR1敲除可同时增加能量消耗并减少脂质吸收,通过两方面共同作用恢复了机体能量代谢的平衡,并且不降低非脂肪重量,是极具潜力的治疗代谢综合征和肥胖的新靶点。
该研究得到了中国医学科学院医学与健康科技创新工程(2021-I2M-1-016),国家自然科学基金、中央高校基本科研业务费、北京市教委及科技部基金等项目的资助。李平平课题组侯少聪、于恒彩和刘彩红为共同第一作者,李平平研究员、崔冰研究员、北京大学基础医学院姜长涛教授和北京友谊医院张鹏主任为共同通讯作者。
文章链接:
https://www.sciencedirect.com/science/article/pii/S2211383524003848