近日,药物所王朝辉团队在国际知名期刊《Advanced Functional Materials》发表题为“A Rationally Designed Cyclic Dinucleotide Amplifier Potentiating STING Activation for Cancer Immunotherapy”的研究论文。该工作创新性地开发了一种仿生纳米递送系统,通过“高效递释-协同作用”策略显著提升了STING天然通路的激活作用,为克服癌症免疫治疗中的关键瓶颈提供了新方案。
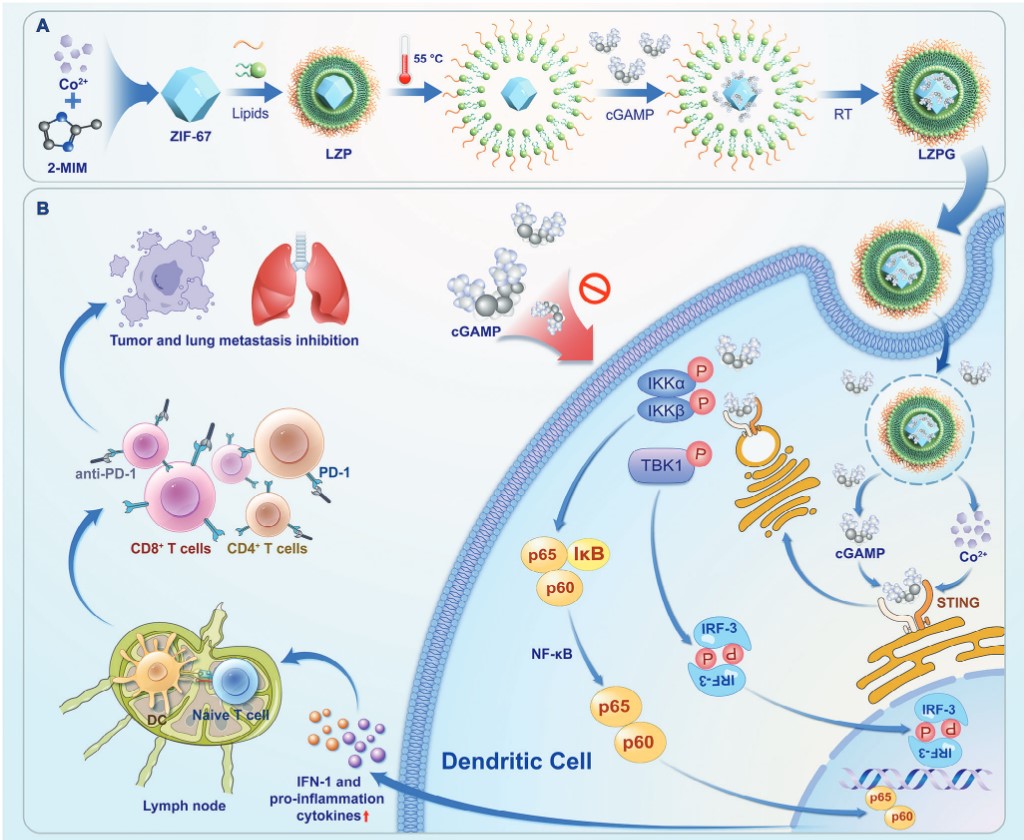
研究团队以金属有机框架为核心,并表面修饰脂质双分子层构建了一种仿生纳米载体LZPG,高效递送CDNs并协同激活STING通路。通过成膜-水化法制备纳米粒,采用主动包封法高效包载药物(cGAMP包封效率≈99%,较传统脂质体的水溶性药物载药方法提高了10倍以上),并能够拓展应用于其他环二核苷类药物。LZPG在酸性肿瘤微环境中富集、迅速释放cGAMP与金属离子,协同激活cGAS-STING通路,诱导I型干扰素及促炎细胞因子分泌,引发特异性T细胞应答。同时,LZPG通过减少调节性T细胞(Tregs)及促使M2型巨噬细胞向M1型极化,有效缓解免疫抑制性肿瘤微环境,诱导级联适应性免疫反应,高效抑制肿瘤生长。并且,该纳米药物在病人肿瘤样本中(乳腺癌和肝癌)同样能够特异性激活STING通路,展现出较好的临床应用潜力,为开发新一代癌症免疫治疗药物提供了工作基础。
该研究得到国家自然科学基金(82473874, 52202356)、中国医学科学院中央级公益性科研院所基本科研业务费基金(2021-RC350-001)、中国医学科学院医学与健康科技创新工程(2021-I2M-1-026, 2022-I2M-1-013)、北京自然科学基金(Z230021)等项目的资助。药物所硕士研究生周梦丽(2024届)、助理研究员梁双、天津肿瘤医院王建研究员、药物所硕士研究生海琳娜为论文的共同第一作者,药物所王朝辉研究员为本论文的通讯作者。
论文链接:https://doi.org/10.1002/adfm.202414918

