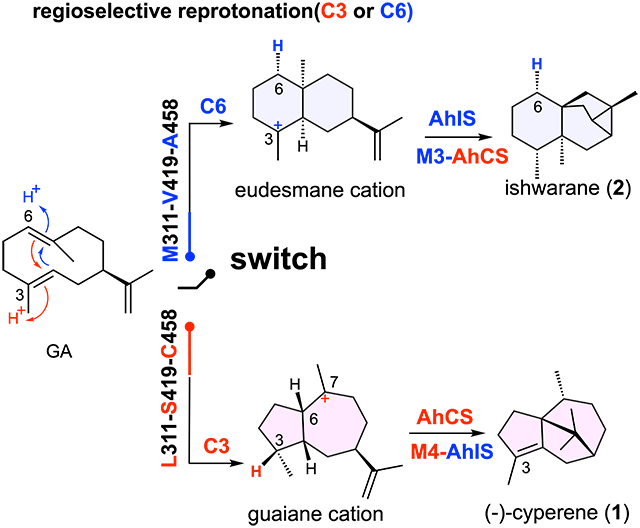
2024年2月7日,中国医学科学院药物研究所天然药物及核药基础与新药创制全国重点实验室庾石山团队和朱平团队在国际化学期刊Angewandte Chemie International Edition (《德国应用化学》)发表了题为“Characterization and Engineering of Two Highly Paralogous Sesquiterpene Synthases Reveal a Regioselective Reprotonation Switch ”(两个高度同源的倍半萜合酶功能表征与蛋白质工程研究揭示一个区域选择性的再质子化开关)的研究论文。该研究从鹰爪(Artabotrys hexapetalus)中发现并鉴定两个高度同源但功能迥异的倍半萜合酶AhCS((−)-cyperene synthase)和AhIS(ishwarane synthase),首次揭示了活性中心的三个氨基酸残基[L311-S419-C458]/[M311-V419-A458]为吉玛烯A(Germacrene A,GA)的C3/C6区域选择性再质子化开关,分别生成结构独特的5/5/6 三环的香附烯((−)-cyperene,1)和6/6/5/3 四环的苡四环烷(ishwarane,2)(见下图)。
倍半萜合酶以法尼基焦磷酸(FPP)为底物,催化一系列复杂反应并产生超过121种结构多样的倍半萜骨架。去质子化-再质子化过程是倍半萜合酶催化反应中常见的质子转移方式,由于再质子化过程中存在不同的区域选择性和立体选择性,极大地增加了倍半萜骨架的多样性。然而,目前对于再质子化的区域选择性的分子基础在很大程度上仍未得到充分研究。
该研究从药用植物鹰爪(A. hexapetalus)中挖掘并鉴定了两个高度同源(91% 氨基酸序列一致性)的倍半萜合酶AhCS和AhIS,分别催化合成上述的化合物1和2。对它们的环化机制进行深入研究发现:尽管AhCS和AhIS通过相同的去质子化过程形成共同的中性中间体GA,却在催化GA再质子化过程中具有不同的区域选择性。经同位素标记实验证实,形成化合物1的再质子化发生在GA的C3位,而产生化合物2的再质子化发生在GA的C6位,这种高度同源的倍半萜合酶催化不同GA质子化的区域选择性为首次报道。
作者假设AhCS和AhIS具有不同的再质子化区域选择性可能与活性腔中差异氨基酸残基有关。为了证实这一假设,采用冷冻电镜解析了AhCS与底物类似物FSPP(farnesyl-thiolodiphosphate)复合体的三维结构,并结合丙氨酸扫描确定了AhCS活性腔内18个关键的氨基酸残基。通过与AhIS活性腔比对,得到了5个差异氨基酸残基。对这5个差异氨基酸残基进行结构导向的突变实验,最终确定了最小突变组合M3-AhCS (AhCS-L311M/S419V/C458A) 和M4-AhIS (AhIS-M311L/V419S/A458C/N542D),可以成功实现AhCS和AhIS功能之间的互换。分子对接和动力学模拟揭示了GA的C3/C6再质子化的区域选择性与不同的质子供体有关。
该项研究揭示了两种高度同源倍半萜合酶催化GA的区域选择性再质子化反应的分子机制,并通过酶结构导向的突变实验成功实现了它们的功能互换。研究结果为设计产生不同骨架结构的倍半萜合酶提供理论基础,同时也为合成天然产物提供了新的思路和方法。
药物所庾石山研究员、朱平研究员,刘云宝研究员和马双刚研究员为该论文的共同通讯作者。药物所博士后叶丹,已毕业硕士生邵一珍和李文睿为共同第一作者。该工作得到了中国医学科学院医学与健康科技创新工程(CIFMS, No. 2022- I2M-JB-009,No. 2021-I2M-1-029)的支持。特别感谢胡友财研究员为该工作提供的重要支持和帮助。
原文链接:https://doi.org/10.1002/ange.202315674