2024年8月14日,中国医学科学院药物研究所天然药物及核药基础与新药创制全国重点实验室吴惊香课题组在Nature在线发表题为“Substrate binding and inhibition mechanism of norepinephrine transporter”(去甲肾上腺素转运体的底物结合和抑制机制)的研究论文。该研究解析了关键的神经系统疾病靶标——人源去甲肾上腺素转运体(Norepinephrine transporter, hNET)三个不同功能状态下的高分辨率结构,揭示了其底物识别及抑制作用机制,为以NET为靶标的药物研发提供了结构基础。
去甲肾上腺素(NA)是一种重要的神经递质,在调节大脑和身体的活跃状态中起着至关重要的作用。NA系统的功能障碍可导致多种疾病的发生,包括交感神经过度活化、注意缺陷多动障碍(ADHD)、抑郁和嗜铬细胞瘤等。NET能将释放的NA再摄取回突触前端,进而控制NA信号的强度和持续时间。NET异常与诸多疾病相关,是重要的成像及治疗靶标。目前,NET底物类似物被广泛用来诊断和治疗多种神经内分泌肿瘤、以及心脏病和帕金森病的诊断;NET抑制剂也用于治疗ADHD、神经退行性疾病、药物滥用、焦虑和抑郁等疾病。因此,阐明NET的底物转运机制以及药物抑制机制是该领域结构药理学的核心问题。
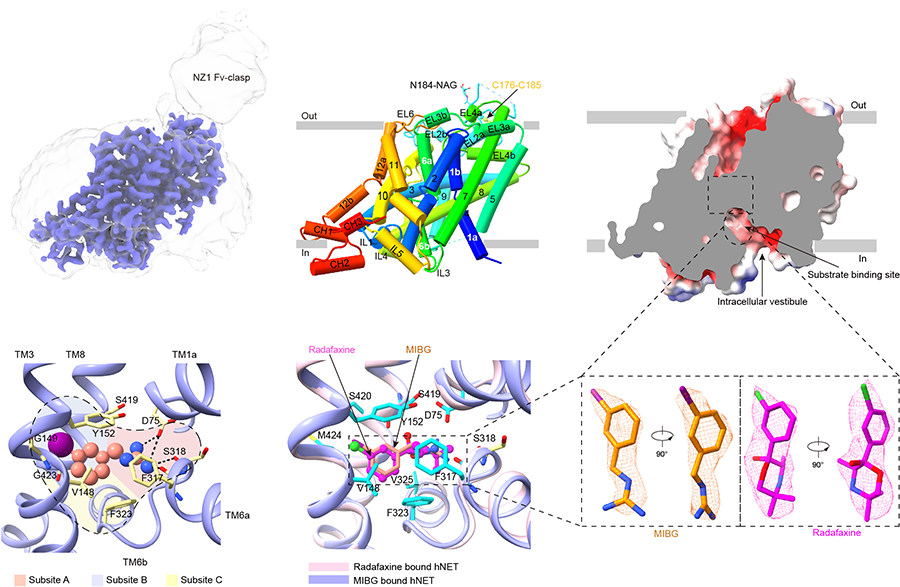
该研究发现无底物结合状态的hNET处于向内开口的构象,胞外门控处的氨基酸形成了多样的电荷互作和氢键网络,使得其关闭状态。MIBG是底物NA的一种合成胍乙啶类似物。核素标记的[123I]MIBG是交感神经系统放射性成像的金标准,能诊断和治疗多种神经内分泌肿瘤。该研究发现MIBG-结合状态的hNET同样处于向内开口的构象,MIBG稳定地结合在底物结合口袋中心,通过氢键以及疏水作用等与hNET的A, B, C三个亚位点的氨基酸发生广泛的相互作用。Radafaxine是安非他酮的活性代谢物,安非他酮可用来帮助戒烟和作为非典型抗抑郁药,是近几年来最常见的处方药之一。该研究发现radafaxine-结合状态的hNET也处于向内开口的构象,radafaxine占据了hNET的底物结合位点,通过与周围氨基酸形成π-π,氢键以及疏水作用等产生稳定的结合,表明其是以正构抑制剂的形式发挥作用。
图 hNET三种功能状态代表性结构、特征以及MIBG和radafaxine结合位点比较
值得一提的是,近期有三项研究分别独立解析了NET结合不同配体,在不同构象下的结构(Hu et al., 2024; Tan et al., 2024; Zhang et al., 2024),这些研究相得益彰,和本研究一起为对NET的机制理解提供了基础,为以 NET为靶标的药物治疗和设计提供了重要参考。
药物所吴惊香研究员为该论文的独立通讯作者,研究生纪文明、缪安然,助理研究员梁凯以及研究生刘佳萌为本文共同第一作者。此外,药物所研究生祁宇涵和周悦,以及北京晶泰技术有限公司的段新丽、孙霁雪和赖力鹏也为本研究提供了帮助。本研究得到国家自然科学基金(32371266)和中国医学科学院中央级公益性科研院所基本科研业务费(2022-RC350-01)基金的资助。冷冻电镜数据的收集得到北京大学冷冻电镜平台和水木未来科技有限公司的技术支持。部分结构的计算也得到了北京大学生命科学中心的计算平台和高性能计算平台的支持。同时,感谢药物所王锐院士、崔冰研究员、李平平研究员、刘陆平研究员、汪小涧研究员以及生物分析中心为该工作提供的大力支持和帮助。
论文链接:https://www.nature.com/articles/s41586-024-07810-5