10月21日,国际顶级化学期刊Angewandte Chemie International Edition (《德国应用化学》) 在线发表了药物所戴均贵团队题为“Novel α-KG/Fe(II)-Dependent Dioxygenases Catalyzing C1β-Hydroxylation and Construction of 5/7/6-Skeleton of Highly Oxygenated Taxoids” (“新颖α-酮戊二酸/亚铁离子依赖性双加氧酶催化高氧化紫杉烷C1位羟基化及5/7/6-紫杉烷骨架的构建”) 的研究论文。该工作是该团队继发现紫杉烷四元氧环合酶(Angew. Chem. Int. Ed. 2024, 63, e202407070)之后的又一突破性进展。该研究从稳产紫杉醇的曼地亚红豆杉培养细胞中发现并功能鉴定了一个新颖的α-酮戊二酸/亚铁离子依赖性双加氧酶 (2-ODD) TmT1βH,该酶负责高效催化高氧化紫杉烷C1位羟基化;同时发现了一个2-ODD酶Tm576,该酶能特异催化6/8/6-型紫杉烷骨架转化为5/7/6-型紫杉烷骨架,并通过计算化学阐明了5/7/6-型紫杉烷骨架的形成机制。
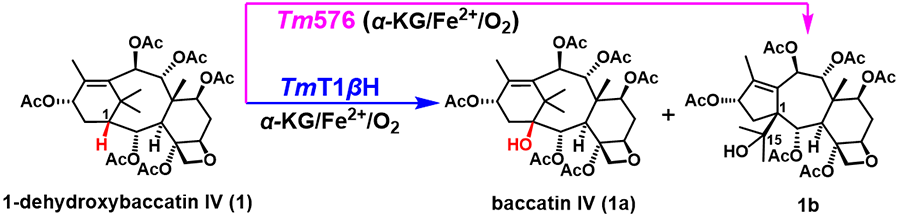
图. TmT1βH和Tm576催化紫杉烷C1-羟基化及5/7/6骨架的形成
众所周知,紫杉醇(taxol)是一种来源于红豆杉中被广泛应用于临床且最有效的抗癌药物之一。但其含量低,且因结构复杂而化学合成困难,导致资源紧缺,价格昂贵。而生物合成被认为是未来生产紫杉醇的一种极有前景的途径。近年来,紫杉醇生物合成的研究取得了巨大进展,几乎所有的酶都已被鉴定出来。然而,关键酶的底物杂泛性和催化功能的多样性导致紫杉醇生物合成呈现复杂的代谢网络形式,而非线性形式,这使得全面且精确解析每个酶在紫杉醇生物合成中的作用颇具挑战性。值得注意的是,目前学术界关于是否存在特异的紫杉烷C1-羟化酶、酶的类型及其底物存在不同见解,因此,澄清这些问题对认识紫杉醇生物合成逻辑进而利用合成生物学进行高效生产具有重要意义。
根据自然界的化学逻辑,紫杉醇生物合成中C1位羟基化可能发生在四元氧环结构单元形成之后,因此,研究人员将四元氧环合酶的产物1-dehydroxybaccatin IV (1)作为候选底物进行C-1位羟化酶的挖掘。首先利用本氏烟草筛选了所有已报道的紫杉醇生物合成相关的一系列725A亚家族的细胞色素P450基因,结果未能发现C1羟基化活性。作者进一步将目光转向了另外一类同样能发挥羟基化作用的α-酮戊二酸/亚铁离子依赖性双加氧酶家族基因,通过本氏烟草成功筛选到了一个能高效、特异性催化底物1-dehydroxybaccatin IV (1) 生成baccatin IV (1a) 的紫杉烷C1羟化酶 (TmT1βH)。LC-MS分析显示,该酶还能够催化底物1生成另外一个微量的氧化产物1b(15-hydroxy-11(15→1)abeo-baccatin IV),即非典型的5/7/6-型紫杉烷类化合物。作者进一步筛选获得了能够特异催化底物1生成1b的氧化酶Tm576,提示非典型5/7/6-型紫杉烷类化合物既可由C1羟化酶催化生成也可通过专一酶介导,这为红豆杉中存在数量众多的5/7/6-型紫杉烷类化合物提供了酶学依据。以上结果说明非典型5/7/6-型紫杉烷类化合物在生物合成上来源于典型的6/8/6-型紫杉烷,这可能使部分紫杉醇途径的中间代谢产物流向5/7/6-型紫杉烷途径,导致红豆杉中紫杉醇含量低并造就了紫杉烷结构多样性。作者进一步通过DFT计算阐明了5/7/6-型紫杉烷骨架是由6/8/6-型紫杉烷骨架通过自由基重排形成。
进一步通过化学法合成不同氧化水平的化合物作为底物探讨了TmT1βH底物谱,发现该酶仅能催化高氧化水平的紫杉烷,通过酶动力学测定观察到该酶对含四元氧环结构单元的高氧化紫杉烷的亲和性更好,表明了紫杉醇C1位羟基化更可能发生在四元氧环形成之后,这与天然存在紫杉烷的化学逻辑一致。最后,作者在本氏烟草中从GGPP起始异源合成了baccatin IV和 VI两个重要中间体。
该研究发现并功能鉴定了能够特异性催化紫杉烷类C1β-羟基化及5/7/6-型紫杉烷形成的两个2-ODD酶,不仅为理解紫杉醇生物合成及紫杉烷结构多样性提供了分子层面的证据,而且为紫杉醇合成生物学制造提供了可靠且高效的元件。
文章的第一作者为药物所博士后李常康,通讯作者为李常康博士和戴均贵研究员。该项目得到了国家重点研发计划(2020YFA0908000)、中央高校基本科研业务费(3332024065)、博士后面上项目(2024M750252)、国家自然科学基金(82404473)以及医科院医学与健康科技创新工程(CIFMS-2024-I2M-TS-013)的支持。
论文链接:https://doi.org/10.1002/anie.202517041