
6月16日,国际顶级化学期刊Angewandte Chemie International Edition (《德国应用化学》)在线发表了中国医学科学院药物研究所戴均贵团队题为“Functional Characterization and Cyclization Mechanism of a Diterpene Synthase Catalyzing the Skeleton Formation of Cephalotane-type Diterpenoids”(“三尖杉烷类二萜骨架形成二萜合酶的功能鉴定及其环化机制”)的研究论文。该研究发现并功能鉴定了三尖杉烯合酶CsCTS,首次明确了海南粗榧内酯等三尖杉烷型二萜前体为三尖杉烯(1,cephalotene),并阐明了其环化机制。
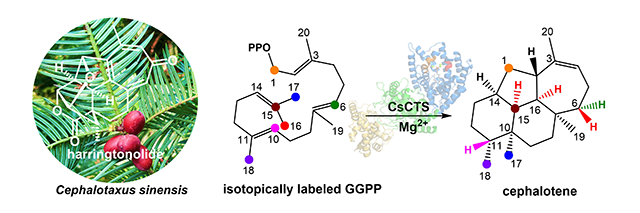
图. 三尖杉烯合酶CsCTS催化合成海南粗榧内酯前体Cephalotene
海南粗榧内酯(harringtonolide,hainanolide)是三尖杉属Cephalotaxus植物中cephalotane-type二萜的代表性成分,最早于1978年由美国学者Buta从日本柱冠粗榧(C. harringtonia)的种子中发现;与此同时,中国医学科学院药物研究所黄量院士团队从我国海南粗榧(C. hainanensis)的树皮中也分离鉴定到该化合物并命名为hainanolide。海南粗榧内酯具有一个刚性骈合的6/6/5/7四环二萜骨架、一个六元内酯桥环和一个四氢呋喃环,分子中共有7个手性中心,骨架新颖独特。药理学研究揭示其具有多种生物活性,尤其对人KB细胞的IC50值达43 nM,极具研发前景。但该化合物在植物中含量极低,且因其结构复杂导致化学合成困难,来源受限。生物合成可为解决这一难题提供新策略,然而,有关海南粗榧内酯生物合成研究未见报道,其二萜合酶、二萜烯骨架及其环化机制仍是谜团。
该研究从粗榧(C. sinensis)中发现了一个I型二萜合酶能够产生一个主产物1和四个脱轨产物(M1‒M4),经NMR、化学衍生和X-射线单晶衍射分析确定了主产物1的结构为三尖杉烯,从而鉴定了该酶的功能,命名为三尖杉烯合酶CsCTS (Cephalotaxus sinensis Cephalotene Synthase)。为阐明CsCTS催化机制,作者鉴定了脱轨产物M1‒M4的结构,发现M1和M2是紫杉二烯合酶TbTS环化中前两步反应的碳正离子脱质子产物,结合生物信息学分析及CsCTS催化特性,提出了三种可能的环化机制(pathways i‒iii)。进一步经同位素标记实验证明了所提出的环化机制中关键的氢迁移、甲基迁移和环化反应;结合密度泛函理论计算,阐明了CsCTS通过pathway i环化机制催化形成cephalotene。
进一步利用分子对接、点突变和分子动力学模拟揭示了CsCTS中负责碳正离子级联反应的两个关键氨基酸残基(W756和F613),其中W756负责稳定A+、F613负责碳正离子B+到D+的1,2-H-迁移和1,2-甲基迁移。有趣的是,通过序列比对、活性中心结构分析及相互突变,发现突变体CsCTS F613 V/I无三尖杉烯形成活性,但可生成少量的紫杉二烯;而紫杉二烯合酶突变体TbTS V610F无紫杉二烯形成活性,但可生成少量的三尖杉烯。这些结果提示:同源性相近的CsCTS/TbTS可能起源于同一祖先,赋予其前期环化机制的相似性;同时,在演化过程中关键氨基酸残基(F613/V610)的突变导致其环化机制出现分歧,进化出功能分支的二萜合酶,从而形成了种属特异性的代谢产物,显示了自然界中植物-基因/酶-途径-代谢产物之间的演化关联性。
该研究发现并鉴定了海南粗榧内酯等三尖杉烷型二萜生物合成第一步反应相关二萜合酶,阐明了其催化机制,为破译和人工构建海南粗榧内酯等三尖杉烷型二萜完整生物合成途径奠定了基础。
中国医学科学院药物研究所天然药物活性物质与功能国家重点实验室、卫健委天然产物生物合成重点实验室、医科院酶与天然药物生物催化重点实验室20级博士研究生李常康和在职博士后王帅为论文第一作者,戴均贵、陈日道研究员及王帅博士为论文共同通讯作者。该项目得到了医科院医学与健康科技创新工程(CIFMS-2022-I2M-2-002)、国家重点研发计划(2020YFA0908000)及山东省自然科学基金(ZR2019PC030)的支持。感谢爱荷华州立大学Reuben Peters教授惠赠pGG和pIRS质粒。
论文链接:https://doi.org/10.1002/anie.202306020